Metallhybride als Energiespeicher
Anwendungen in Batterien und Brennstoffzellen
| Adresse der Autoren
Dr. Andreas Züttel und Prof. Dr. Louis Schlapbach, Universität Fribourg Physik-Institut, Pérolles, 1700 Fribourg |
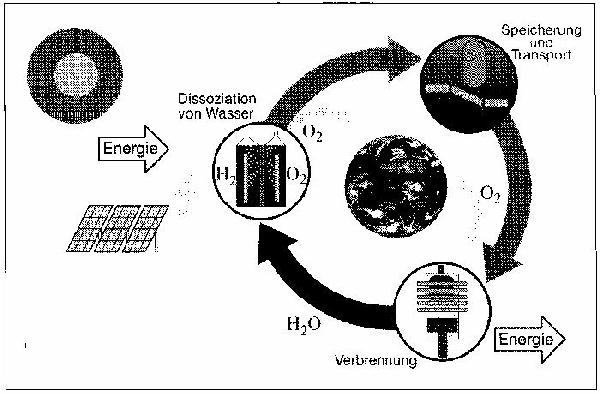
Das Hauptvorkommen für Wasserstoff auf der Erde sind die Ozeane. Zwei Wasserstoffatome bilden zusammen mit einem Sauerstoffatom das Wassermolekül. Wasserstoffgas (H2) kann daher durch elektrochemische Spaltung (Elektrolyse) des Wasserrnoleküls gewonnen werden. Die dazu notwendige Energie tiefert zum Beispiel die Sonne. In photovoltaischen Zellen wird die Sonnenenergie in hochwertige elektrische Energie umgewandelt, welche zur Dissoziation (Spaltung) von Wasser in Wasserstoff und Sauerstoff eingesetzt oder direkt in Batterien gespeichert werden kann. Der bei der Elektrolyse entstehende Sauerstoff kann in die Umgebung entweichen und wird auf nattüliche Weise in der Atmosphäre verteilt.
Transport und Lagerung von Wasserstoff sind Verhältnismässig
aufwendig. Der Wasserstoff wird gasförmig in Drickflaschen oder flüssig
in Kryobehältern bei -253 C züm Verbraucher transportiert. Hier
wird er dann mit Sauerstoff zu Wasser verbrannt (thermisch oder in einer
Brennstoffzelle). Die dabei freiwerdende Energie kann genutzt werden. Von
der Elektrolyse des Wassers bis zur Verbrennung des Wasserstoffs ergibt
sich so ein Kreislauf (Bild 1), in dem die Sonnenergie temporär
gespeichert und zum Verbraucber transportiert wird.
(cliquer sur les images pour avoir la taille réelle)
Die heute gebräuchlichen Methoden zur Lagerung von Wasserstoff sind seiner industriellen Verwertung angepasst und bieten die dazu nötige Sicherheit. Die Lagerung von gasförmigem Wasserstoff verlangt dickwandige Stahlbehäliter. Bei einem Druck von 136 bar wiegt Wasserstoff zusammen mit der Stahlflasche rund 30mal soviel wie eine energetisch gleichwertige Menge Benzins, wobei 99% des Gewichts auf die Stahlflasche entfallen. Gleichzeitig braucht der Behälter 24mal soviel Platz wie ein entsprechender Benzintank. Ausser durch hohen Druck kann der Volumenbedarf von Wasserstoff auch durch Verflüssigung verringert werden. Dazu muss dem Gas so lange Wärme-energie entzogen werden, bis es bei -253 C zu Flüssigkeit kondensiert. Dieser Prozess benötigt 40-50% derjenigen Energie, die später bei der Verbrennung gewonnen werden können.
Wasserstoff kann mit Luft in Verbrennungsmotoren oder thermischen Anlagen verbrannt werden. Die Verbrennung ist umweltfreundlich. weil das Reaktionsprodukt Wasser nur Spuren von Stickoxiden (NOx) enthält. Wasserstoff kann auch in Brennstoffzellen mit Luft oder Sauerstoff verbrannt werden. Dabei entsteht wie in einer Batterie auf direktem Wege elektrische Energie.
Eine alternative und sichere Methode zur Speicherung des Wasserstoffes stellen die Metallhydride dar. Dabei handelt es sich um elementare Metaille oder Metallegierungen, in denen Wasserstoff gelöst werden kann. Metallhydride stellt man entweder durch Beladen des Metalls mit gasförmigem Wasserstoff, durch elektrochemisches Beladen oder direkt aus wasserstoffhaltigen Verbindungen her.
Metallhydride
Viete elementare Metalle, intermetallische Verbindungen und ein- oder
mehrphasige Legierungen sind in der Lage, Wasserstoffatome (H) oder die
Isotope Deuterium (D) und Tritium (T) zwischen den Atomen des Metallgitters
einzulagern und chemisch zu binden. Diese Einagerungsverbindungen nennt
man Metallhydride, Metall-Wasserstoff-Legierungen oder auch Wasserstoffschwämme.
Metalle, die Wasserstoff «ohne grossen Aufwand» absorbieren
und desorbieren, können als reversible Speicher für Wassertoff
eingezetzt werden. Ein Metallhydridspeicher wird charakterisiert durch:
Steht ein Metall mit dem Wasserstoffgas im Gleichgewicht (Bild 2), so wird anfänglich Wasserstoft im Metall auf Zwischengitterplätzen gelöst (Festkörperlösung).
In dieser Lösungsphase (alpha-Phase) steigt bei kleiner Konzentration der Wasserstoffdruck an. Erreicht die Konzentration einen bestimmten Wert (ungefähr 0,1 Wasserstoffatom pro Metallatom), beginnt sich die Hydridphase (bêta-Phase) aus der Lösungsphase zu bilden. Im Bereich der Koexistenz von Lösungsphase und Hydridphase wächst die Konzentration bei konstantem äusserem Druck (Plateau). Nachdem die Hydridphase volständig ausgebildet ist, kann weiter Wasserstoff in der Hydridphase gelöst werden. Der Gleichgewichtsdruck steigt jetzt wieder mit der Konzentration an. Der Plateaudruck und die Plateaulänge in den Druck-Konzentrations-Isothermen sind temperaturabhängig. Es gibt eine kritische Temperatur Tc, bei der das Plateau verschwindet. Für Temperaturen T >Tc erfolgt der Übergang alpha => Beta kontinuierlich. Bei einer gegebenen Temperatur T ist der Plateaudruck für die Isotope D2 und T2 verschieden vom Plateaudruck für Wasserstoff (H2). Dieses Phänomen, der sogenannte Isotopeneffekt, kann zur Trennung der verschieden Isotope des Wasserstoffes genutzt werden.
Wasserstoffatome, die im Kristallgitter des Metalls zwischen die Metallatome eingelagert werden, besetzen entweder tetraedrisch oder oktaedrisch angeordnete Zwischengitterplätze. Im ersten Fall ist jedes Wasserstoffatom von vier, imzweiten von sechs Metallatomen umgeben. Das Wasserstoffatom ist zwar klein und wird durch die chemische Bindung an das Metall noch kleiner, dennoch verspannt und verzerrt der Einbau des Wasserstoffatoms das Metallgitter gewaltig. Das Kristallgitter des Metallhydrids ist im Vergleich zum Gitter des reinen Metalls um 10 bis 20 Vol.-% gedehnt. Die Dehnung erfolgt oft anisotrop, das heisst, das Metall dehnt sich in die verschiedenen Kristallrichtungen unterschiedlich stark aus.
Ein nur teilweise beladenes Metall besteht aus einem Gemisch von voll beladenen und fast leeren Metallbydrid-Körnern. Dadurch entstehen mechanische Spannungen, die spröde Metalle beim ersten Beladen zum Zerbrechen bringen können. Dabei entsteht ein Pulver mit einer Korngrösse =5 bis 10 µm. Die Rissbildung und das Zerfallen sind extreme Folgen der Versprödung von Metallen durch die Absorption von Wasserstoffn (Bild 3). Nach mehreren Absorptions-Desorptionszyklen wird meistens eine stabile Korngrösse <=5 µm mit einer spezifischen Oberfläche von 0,1 bis 1 m2/g erreicht. Der Effekt der Versprödung durch Wasserstoffabsorption wird in der Fabrikation von Permanentmagneten aus SmCo5 und Nd2Fe14B anstelle des mechanischen Pulverisierens angewendet.
Für viele Anwendungen geeignete Metallhydride weisen emen Plateau-Gleichgewichtsdruck Peq = 1 bar bei Zimmertemperatur (300 K) auf, was einer Bildungsenthalpie AH = -19 kJ/mol H entspricht. Die Bildungsenthalpie hängt stark mit der Zusammensetzung der intermetallischen Verbindungen zusammen und lässt sich in gewissen Bereichen durch geeignete Wahl der Elemente beeinflussen. Die Bildung des Metallhydrids führt zu einer grossen Entropieänderung im System, die sich durch eine starke Wärmetönung der Reaktion bemerkbar macht. Die Entropieänderung ist hauptsächlich durch das Wasserstoffgas gegeben und somit für die meisten Hydride etwa gleich gross. Bei der exothermen Absorption wird Wärme frei (rund 19 kJ/mol H). Diese Wärme muss dem Speicher bei der endothermen Desorption wieder zugeführt werden.
Im bisher beschriebenen idealisierten Metallhydrid ist das Plateau exakt flach und die kleinste Differenz zwischen Gasdruck und Plateaudruck verursacht Absorption oder Desorption entlang des Plateaus. In einem realen Metall-Wasserstoff-System liegt der Plateaudruck für die Absorption etwas höher als für die Desorption (Hysterese). Die Konzentration des Wasserstoffs irn Metallhydrid verhät sich also ähnlich wie die Magnetisierung in einem ferromagnetischen Metall. Zudem ist das Plateau nicht exakt flach, sondern steigt mit wachsender Konzentration leicht an.
Die Wasserstoff-Absorption und -Desorption veliaufen nicht beliebig schnell; die Reaktion beinhaltet mehrere aufeinanderfolgende Schritte: Diffusion im Gas, Chemisorption und Dissoziation des Moleküls, Diffusion im Metallgitter Nukleation und Wachstum der Rydridphase. Der langsamste Schritt bestimmt die Kinetik der Wasserstoff-Absorption und -Desorption. Dabei spielt die Oberfläche der Metalle, also der Chemisorptionsschritt, eine entscheidende Rolle. Metalle, die mit Luft in Kontakt waren, sind mit Oxidschichten belegt, welche oft die Oberflächenreaktionen hemmen oder blockieren. Einen ähnlichen Effekt haben auch auf der Oberfläche absorbierte Spuren von S02, H2S oder CO. In solchen Fällen können Aktivierungsprozesse im Vakuum oder in Wasserstoff erforderlich sein.
In aktivierten Metallhydridbetten techniseher Grösse ist die Kinetik immer duirch den Wärmeaustausch begrenzt. Im Absorptionsprozess führt die Reaktionswärme bei ungenügendem Wärmeaustauch zu einer Temperaturerhöhung und damit zu einer Erhöhung des Plateaudruekes Peq(T), bis der von aussen angelegte Wasserstoffgasdruck nicht mehr ausreicht; um die Reaktion aufrecht zu erhalten.
Anwendungen Von Metallhydriden
Die Anwendungen Von Metallhydriden sind von mannigfaltiger Natur. Vor
allem werden sie als Speicher von gasförmigem Wasserstoff, als Elektroden
in elektrochemischen Zeilen (wiederauladbare Batteflen), als Wärmepumpen
und Quellen atomaren Wasserstoffs oder zur Reinigung Von Wasserstoff eingesetzt.
Elektroden, in wiederaufladbaren Batterien, stellen wirtschaftlich die wichtigste Anwendung dar. Diese Batterien haben heute bereits ein grösseres Marktvolumen als Nickel/Cadmium-Batterien (Ni/Cd). Metallhydrid-Batterien (MH) weisen eine höhere Energiediechte als Ni/Cd-Batterien auf und zeigen keinen Memory-Effekt. Zudem sind MH-Batterien frei von Cadmium und Quecksilber. Die Metallhydrid-Batterie besteht aus einer Metailhydrid- und einer Nickelhydroxid-Elektrode (Bild 4):
Beim Entladen reagiert an der Metallhydrid-Elektrode der Wasserstoff
mit den Hydroxidionen im Elektrolyten zu Wasser, und ein Elektron verbleibt
auf der Elektrode. An der Gegenelektrode entsteht aus dem Wasser und einem
Elektron wiederum ein Hydroxidion. Die Gesamtreaktion ist vollständig
reversibel. Die Lebensdauer der Metallhydridbatterien ist jedoch
beschränkt durch Korrosion der Metall-Elektrode und durch den Verlust
von Elektrolytflüssigkeit durch Überladen. Die MH-Batterien weisen
eine Spannung von 1,2 V und Energiedichten von rund 60 Wh/kg auf. Moderne
Zellen können bis zu 1500 mal wieder aufgeladen werden und lassen
sich in weniger als einer halben Stunde vollständig entladen. Wesentlicher
Nachteil der MR-Batterien ist die grosse Masse der zurzeit eingesetzten
Speicherlegierungen mit Dichten von 5 bis 7 g/cm3. Die Forschungsaktivitäten
auf dem Gebiet der Metallhydride zielen deshalb darauf, Wasserstoff-Speichermaterialien
mit niedrigerer Dichte und höherer Energiedichte zu suchen. Wir
konnten kürzIich zeigen, dass bestimmte röhrenförmige
Kohlenstoffstrukturen (Nanotubes) im Elektrolyten pro Masse mehr als doppelt
soviel Wasserstoff speichern können als die heute in MH-Batterien
eingesetzten Legierungen.
Aufgrund der Fortschritte in der Brennstoffzellenentwicklung wird die stationäre und mobile Speicherung von Wasserstoffgas schon in naher Zukunft an Bedeutung gewinnen. Metallhydride eignen sich besonders gut für diese Anwendung, weil sie etwaige Verunreinigungen binden können. Während der Wasserstoff absorbiert, gespeichert und wieder desorbiert wird, reagieren Verunreinigungen irreversibel mit dem Metall und werden gebunden. Der desorbierte Wasserstoff ist daher ultra rein (weniger als 10 ppb Verunreinigungen). Dadurch wird verhindert, dass die empfindlichen Elektroden in Brennstoffzellen vergiftet werden. Die leider noch schweren Speicher enthalten etwa 1 bis 5 Gew.-% Wasserstoff.
Metallhydride lassen sich in FCKW (Fluor-Chlor-Kohlenwasserstoffe)-freien thermischen Maschinen einsetzen. Dabei werden zwei Metalhhydride 1 und 2 unterschiedlicher Stabilität je zu einem Metallhydridbett verpackt und können zum Beispiel als Wärmepumpe in einem stofflich geschlossenen System geschaltet werden. Ein und derselbe Wasserstoff wird bei verschiedenen Temperaturen Tmittel, Ttief und Thoch zwischen beiden Hydriden hin und ber gepumpt. Vorteil solcher thermischer Maschinen wie Wärmepumpen, Kühlmaschinen und Kompressoren auf der Basis von Metallbydriden ist, dass diese Anlagen keine mechanisch bewegten Teile aufweisen.
Heute stehen wir nicht nur kurz vor dem Beginn eines neuen Jahrtausends; die Zeit ist auch rauf für einen neuen Umgang mit Energie. Wir stehen kurz vor dem Ubergang aus einer Zeit, in der die Menschheit natürliche Reserven wie die fossilen Brennstoffe abbaut und irreversibel verbrennt, in eine Zeit nachhaltiger reversibler Wasserstofftechnologie.
Literatur
[1] L. Schlapbach (ed.): Hydrogen in Intermetallic Compounds
I. Springer Series Topics in Applied Physics, Vol. 63 (1988).
[2] L. Schlapbach (ed.): Hydrogen in Intermetallic Compounds
II. Springer Series Topics in Applied Physics, Vol. 67 (1992).
[3] J.H. Westbrook and R.L. Fleischer (eds.):
Intermetallic Compounds. New York: John Wiley & Sons 1995.
[4] H. Buchner: Energiespeicherung in Metallen. Wien,
New York: Springer Verlag 1982.
[5] G. Alefeld and J. Völkl (eds.): Hydrogen in
Metals I. Springer Series Topics in Applied Physics Vol. 28 (1978).
[6] G. Alefeld and J. Völkl (eds.): Hydrogen
in Metals Il. Springer Series Topics in Applied Physics Vol. 29 (1978).